
Для определения химической формулы органического вещества небольшую его массу сжигают, а затем исследуют продукты сгорания. Так, например, при сжигании 3,75 г формальдегида получили 2,25 г водяного пара и 5,5 г оксида углерода (IV). Установили, что плотность паров формальдегида по водороду 15. Пользуясь этими данными, находят, сколько граммов углерода и водорода содержится в 3,75 г формальдегида: M (CO2 ) = 12 + 32 = 44; M = 44 г / моль 44 г CO2 содержит 12 г 5,5 г CO2 » x1 44 ÷ 5,5 = 12 ÷ x1; x1 = (5,5 · 12) / 44 = 1,5; m (C) = 1,5 г M (H2O) = 2 + 16 = 18; M = 18 г / моль 18 г H2O содержит 2 г 2,25 г H2O » x2 18 ÷ 2,25 = 2 ÷ x2; x2 = (2,25 · 2) / 18 = 0,25; m (H) = 0,25 г Находят общую массу углерода и водорода: x1 + x2 = 1,5 + 0,25 = 1,75
Так как для сжигания было взято 3,75 г формальдегида, то можно вычислить массу кислорода: 3,75 - 1,75 = 2; m (O) = 2 г
Определяют простейшую формулу: C : H : O = (1,5 ÷ 12) : (0,25 ÷ 1) : (2 ÷ 16) = 0,125 : 0, 25 : 0,125 = 1 : 2 : 1 Следовательно, простейшая формула исследуемого вещества CH2O. Зная плотность паров формальдегида по водороду, вычисляют его молярную массу: M = 2D (H2 ) = 2 · 15 = 30; M = 30 г / моль
Находят молярную массу по простейшей формуле: M (CH2O) = 12 + 2 + 16 = 30; M (CH2O) = 30 г / моль Следовательно, молекулярная формула формальдегида CH2O В молекуле формальдегида между атомами углерода и водорода существуют σ—связь, а между атомами углерода и кислорода — одна σ— и одна π—связь.
Для альдегидов характерна изомерия углеводородного радикала. Он может иметь либо неразветвленную, либо разветвленную цепь. Названия альдегидов происходят от исторических названий соответствующих органических кислот, в которые они превращаются при окислении (муравьиный альдегид, уксусный альдегид, пропионовый альдегид и др.). По международной номенклатуре названия альдегидов производят от названий соответствующих углеводородов с прибавлением суффикса -аль.
Важнейшие представители альдегидов.
Метаналь, или формальдегид*
Этаналь, или ацетальдегид*
Пропаналь
Бутаналь
2-Метилпропаналь
Пентаналь
Гексаналь

В лаборатории альдегиды получают окислением первичных спиртов. В качестве окислителей применяют оксид меди (II), пероксид водорода и другие вещества, способные отдавать кислород. В общем виде это можно показать так:
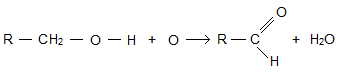
В промышленности альдегиды получают различными способами. Экономически наиболее выгодно получать метаналь непосредственным окисление метана кислородом воздуха в специальном реакторе. Чтобы метаналь не успел окислиться, смесь метана с воздухом через зону реакции пропускают с большой скоростью. Метаналь получают также окислением метанола, пропуская его пары вместе с воздухом через реактор с раскаленной медной или серебряной сеткой. Однако этот способ экономически менее выгоден. Этаналь можно получить и гидратацией ацетилена в присутствии солей ртути в качестве катализатора (реакция М. Г. Кучерова). Так как в этой реакции в качестве катализатора используют ядовитые вещества — соли ртути, то в последнее время разработан новый метод получения ацетальдегида: смесь этилена с воздухом пропускают через водный раствор солей меди, железа и палладия.
Метаналь — бесцветный газ с резким запахом. Раствор метаналя в воде (35 - 40%-ный) называется формалином. Остальные члены ряда альдегидов — жидкости, а высшие — твердые.
Для альдегидов наиболее характерны реакции окисления и присоединения.
1. Реакции окисления
а) Качественной реакцией на альдегиды является реакция «Серебряного зеркала». Для ее осуществления в чистую пробирку наливают аммиачный раствор оксида серебра (I) (Ag2O в воде практически не растворяется, но с аммиаком образует растворимое соединение [Ag (NH3)2]OH), к нему добавляют раствор альдегида и нагревают. Восстановленное серебро оседает на стенках пробирки в виде блестящего налета, а альдегид окисляется в соответствующую органическую кислоту. б) Другой характерной реакцией является окисление альдегидов гидроксидом меди (II). Если к голубому осадку гидроксида меди (II) прилить раствор альдегида и смесь нагреть, то сначала появляется желтый осадок гидроксида меди (I), который при дальнейшем нагревании превращается в красный оксид меди (I). В этой реакции окислителем является медь со степенью окисления +2, которая восстанавливается до степени окисления +1.
2. Реакции присоединения
Реакции присоединения обусловлены наличием в карбонильной группе π—связи, которая легко разрывается. По месту ее разрыва присоединяются атомы и атомные группы. Так, например, при пропускании смеси метаналя с водородом над нагретым катализатором происходит его восстановление в метанол. Аналогично присоединяют водород и другие альдегиды.
Другие заметки по химии